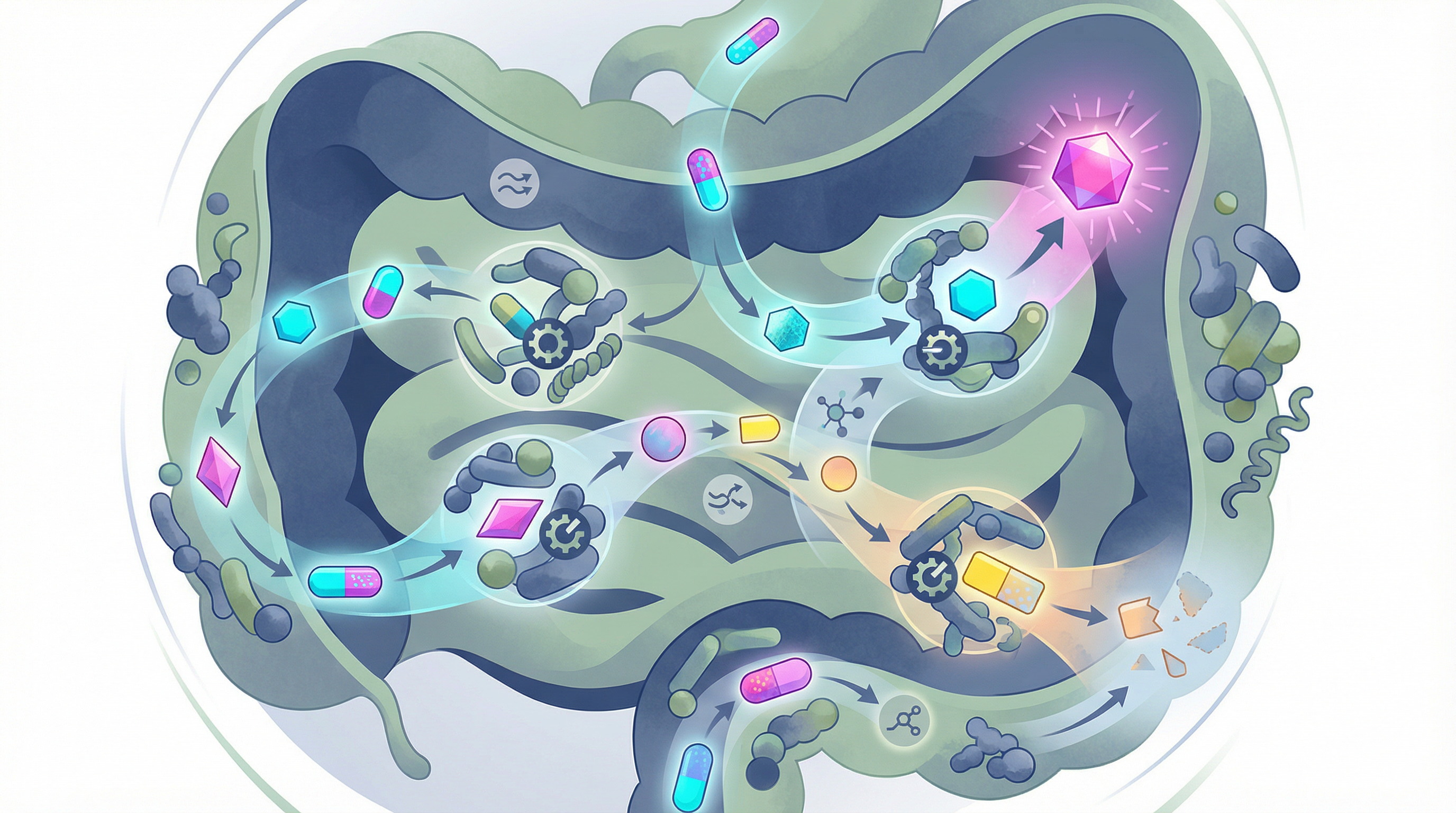
Perché a parità di trattamento farmacologico alcune persone rispondono peggio (o non rispondono affatto) rispetto ad altre? Non è solo questione di farmacogenetica ma anche di microbioma.
Alcuni esempi di come i batteri del microbiota possono metabolizzare i farmaci: 🔹 Digossina. Glicoside cardioattivo derivato dalla digitale e utilizzato nel trattamento dell'insufficienza cardiaca e di alcune aritmie: viene inattivato nel tratto gastrointestinale da Eggerthella lenta, presente nel microbiota di circa il 30-40% della popolazione. Alcuni ceppi di E.
lenta (cosiddetti ceppi "metabolizzatori"), hanno un operone specifico, denominato "cardiac glycoside reductase" (cgr), che riduce la digossina a diidrodigossina, un metabolita con scarsa attività farmacologica. 🔹 Metformina. Biguanide di prima linea nel trattamento del diabete di tipo 2; inibisce il complesso I mitocondriale, con conseguente riduzione dello stato energetico cellulare (aumento del rapporto AMP/ADP) che a sua volta attiva l'AMPK (proteina chinasi attivata da AMP), un sensore energetico cellulare che inibisce la gluconeogenesi epatica e promuove l'assorbimento del glucosio nei tessuti periferici.
La metformina altera significativamente la composizione della flora intestinale; ad esempio up-regola Akkermansia e questi cambiamenti microbici contribuiscono a loro volta agli effetti terapeutici della metformina (gli effetti insulino-sensibilizzanti di Akkermansia sono emersi da altri studi). 🔹 L'irinotecano (CPT-11). Chemioterapico utilizzato nel trattamento di diverse neoplasie, tra cui il carcinoma colorettale, è un profarmaco che viene attivato dall'enzima carbossilesterasi a SN-38, il suo metabolita attivo, responsabile dell'effetto citotossico (inibizione della topoisomerasi I).
Nel fegato, SN-38 viene inattivato attraverso glucuronidazione da parte delle UDP-glucuronosiltransferasi (UGT), formando SN-38G, un metabolita inattivo che viene escreto nella bile e raggiunge l'intestino. È qui che entra in gioco il microbiota intestinale: i batteri presenti nel colon producono β-glucuronidasi, enzimi capaci di idrolizzare il legame glucuronico di SN-38G, rilasciando nuovamente SN-38 attivo nel lume intestinale, rendendolo di nuovo attivo, stavolta sulla mucosa intestinale. Questa riattivazione locale di SN-38 nell'intestino è responsabile di uno degli effetti collaterali più limitanti dell'irinotecano: la diarrea severa, che colpisce fino al 40% dei pazienti trattati e spesso costringe a limitare o rallentare la terapia.
🔹 Nivolumab. Particolarmente promettente è l'interazione microbiota-immunoterapia: la presenza di specifici taxa (Akkermansia, Bifidobacterium) correla con una migliore risposta agli inibitori PD-1: liberare tutta la potenza di questa nuova classe di farmaci è una delle sfide più importanti e promettenti della lotta contro il cancro ed il microbiota ne sarà protagonista.